 备战中考化学二模试题分类汇编科普阅读题综合及答案解析Word文档格式.docx
备战中考化学二模试题分类汇编科普阅读题综合及答案解析Word文档格式.docx
- 文档编号:3286126
- 上传时间:2023-05-01
- 格式:DOCX
- 页数:36
- 大小:406.31KB
备战中考化学二模试题分类汇编科普阅读题综合及答案解析Word文档格式.docx
《备战中考化学二模试题分类汇编科普阅读题综合及答案解析Word文档格式.docx》由会员分享,可在线阅读,更多相关《备战中考化学二模试题分类汇编科普阅读题综合及答案解析Word文档格式.docx(36页珍藏版)》请在冰点文库上搜索。
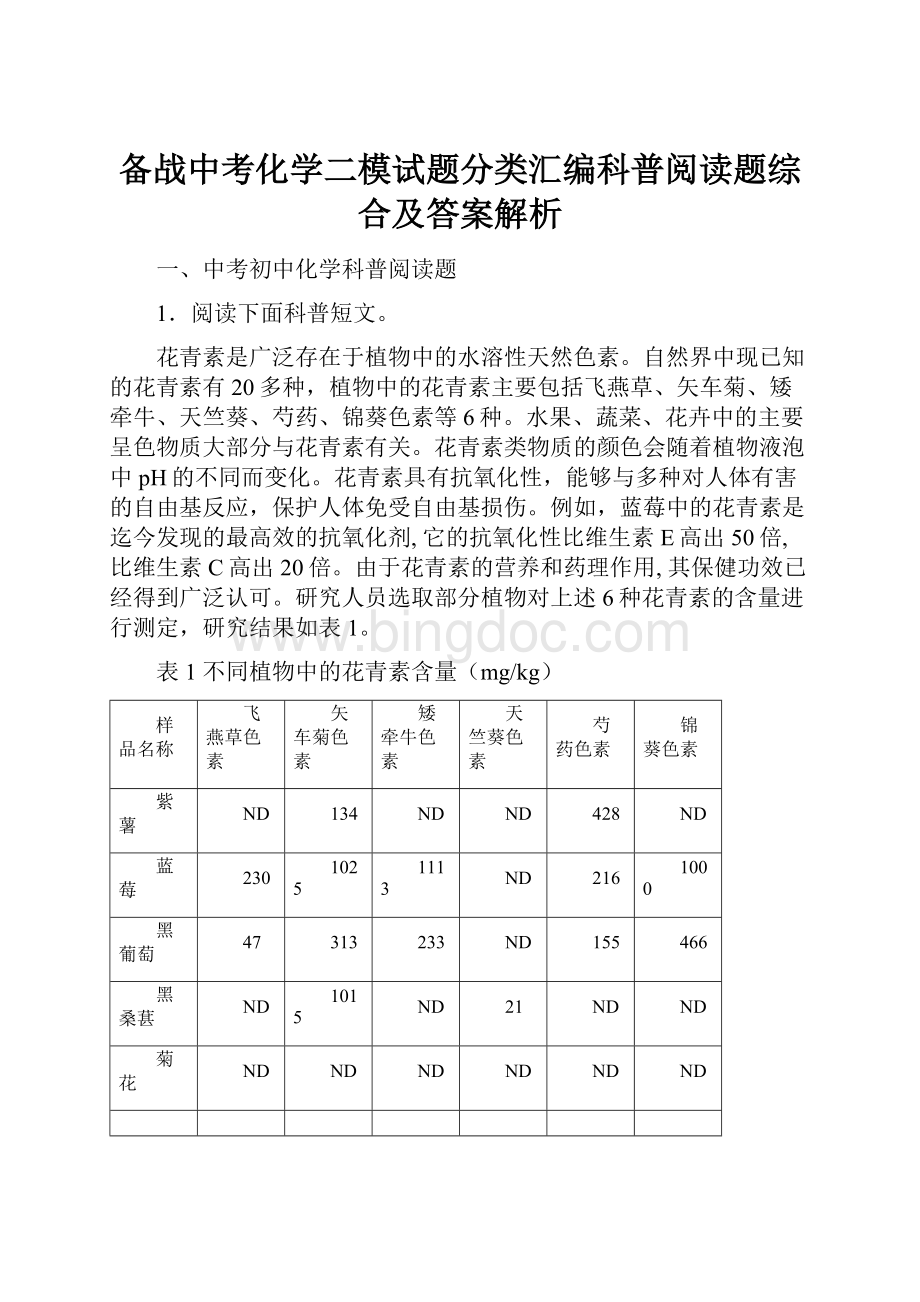
黑桑葚
1015
21
菊花
*ND表示在该植物中未检出该类花青素。
由于花青素本身性质不稳定,易受环境因素的影响,其应用受到一定限制。
温度和光照影响花青素的稳定性,高温和光照会加快花青素降解的速率;
科研人员还研究了pH对蓝莓花青素稳定性的影响,结果如图所示。
因此,在加工和储存过程中注意调控上述因素,维持并提高花青素稳定性是花青素类产品开发的关键。
依据文章内容回答下列问题。
(1)矢车菊色素(C15H11O6)中碳、氢、氧原子的个数比为:
_________。
(2)文中提到花青素的化学性质有(写出一条即可)_________。
(3)根据表1,若要补充花青素,首选的食物是_________。
(4)由图1得出的结论为_________。
(5)下列说法正确的是(填字母序号)_________。
A花青素有可能用于制作酸碱指示剂
B菊花不适合提取花青素
C富含花青素的食品尽量避光、避免高温保存
D只有富含花青素的食物才具有抗氧化性
【答案】15:
11:
6与自由基反应(或颜色随pH值不同而改变、抗氧化性、受热易分解等)蓝莓在pH1~8范围内,随着pH增大,花青素稳定性变差(或保存率变低)ABC
【解析】
【分析】
化学性质是通过化学变化表现出来的,物理性质是不通过化学变化就有的性质。
【详解】
(1)矢车菊色素(C15H11O6)中碳、氢、氧原子的个数比为15:
6。
(2)化学性质是通过化学变化表现出来的,文中提到花青素的化学性质有与自由基反应。
(3)蓝莓中的花青素是迄今发现的最高效的抗氧化剂,若要补充花青素,首选的食物是蓝莓。
(4)由图1得出的结论为在pH1~8范围内,随着pH增大,花青素稳定性变差。
(5)A、花青素在酸性和碱性环境中都可以保持,则有可能用于制作酸碱指示剂,故A正确;
B、菊花基本不含花青素,则不适合提取花青素,故B正确;
C、温度和光照影响花青素的稳定性,高温和光照会加快花青素降解的速率,则富含花青素的食品尽量避光、避免高温保存,故C正确;
D、维生素C、维生素E也具有抗氧化性,所以不具有花青素的食物也可能具有抗氧化性,故D不正确。
故选ABC。
2.阅读下面科普短文,回答问题。
油纸伞的味道•桐油
桐油是一种天然的植物油,主要成分为α﹣桐酸(化学式C18H30O2)和三油精,是油桐树果实经机械压榨,加工提炼制成的。
它具有良好的防水性、迅速干燥、耐高温、耐腐蚀等特点。
桐油又分生桐油和熟桐油两种,生桐油用于医药和化工;
熟桐油由生桐油加工而成,可代替清漆和油漆等涂料,桐油使美丽而充满古韵的油纸伞能遮风避雨。
从直观上判断,熟桐油较生桐油粘稠,且颜色呈深咖啡色。
2010年《中国宁德水密隔舱福船制造技艺》被列入“世界级非物质文化遗产名录”。
造船除木料外,辅助材料有船钉、桐油灰、竹丝、油漆等。
桐油灰属无机胶凝材料,明《天工开物》一书中有关于在古建筑中用桐油﹣﹣石灰作为腻子的记载。
桐油灰中熟桐油和生石灰(主要成分氧化钙)的比例是1:
3.木船的缝隙用桐油石灰填充,起胶合作用,将木船的每块船板粘贴成一个整体,不会从船底里渗水,木船就可以在水中启航。
请根据文章内容回答下列问题:
(1)油桐树果实经机械压榨提炼桐油的过程是___(填“物理”或“化学”)变化。
(2)写出桐油石灰的原料之一氧化钙中钙离子符号___。
(3)如何区分熟桐油与生桐油___。
(4)在古建筑中用作腻子原料的桐油──石灰属于___(填“纯净物”或“混合物”)。
(5)α﹣桐酸(化学式C18H30O2)中氢元素与氧元素的质量比为___。
【答案】物理Ca2+熟桐油较生桐油粘稠,且颜色呈深咖啡色混合物15︰16或30︰32
本题考查了物质的性质,离子符号,物质的分类以及根据化学式的计算等。
(1)油桐树果实经机械压榨提炼桐油的过程中没有新物质生成属于物理变化。
(2)氧化钙中钙离子符号是Ca2+。
(3)根据题中信息可知熟桐油较生桐油粘稠,且颜色呈深咖啡色;
(4)桐油──石灰中是用熟桐油和生石灰(主要成分氧化钙)的比例是1:
3制成,由不同种物质组成,属于混合物;
(5)α-桐酸(化学式C18H30O2)中氢元素与氧元素的质量比=1×
30:
16×
2=30︰32=15︰16。
点睛:
认真阅读,找出有用信息,根据已有知识进行分析。
3.海水是名符其实的液体矿产,平均每立方公里的海水中有3570万吨的矿物质,世界上已知的100多种元素中,80%已经在海水中找到。
海水是盐的“故乡”,海水中含有各种盐类,其中90%左右是氯化钠,也就是食盐。
另外还含有MgCl2、MgSO4、CaCl2、KI及NaBr等各种盐类。
氯化镁是点豆腐用的卤水的主要成分,味道是苦的,因此,海水晒盐后所得的母液中含有较多的氯化镁,也叫“苦卤”。
根据上述阅读材料回答问题:
(1)海水中含有的阴离子包括Cl-、SO42-及_____(写出一种微粒符号即可)等;
(2)苦卤中的溶质主要有:
氯化镁、金属溴化物和_______(写出一种物质);
(3)工业上把苦卤除钙后,再加入碱性沉淀剂可以制备氢氧化镁。
若海水中钙离子含量太高,氢氧化钙会存在于氢氧化镁颗粒中,从而影响氢氧化镁的纯净度。
某研究小组在控制反应温度是20~25℃和浓海水质量为1109g不变的条件下,进行下述对比实验,数据如下:
实验
碳酸钠加入量/g
搅拌速度r/min
反应时间/h
钙除去率/%
a
1.78
200
3
44.8
b
2.32
60.2
c
125
4
55.1
d
64.6
①该对比实验中发生反应的化学方程式是_____;
②进行实验a和b的目的是__________。
③该实验显示________(填实验因素)对钙的除去率的影响很小;
④搅拌速率越快,反应时间越长则消耗能源越多。
为了节约能源,获得较高的钙除去率,进一步优化“搅拌速率”和“反应时间”的反应条件。
在其他实验条件不变情况下,设计对比实验,你应选择的反应条件是_____(填选项)。
A200r/min,3.5hB200r/min,4.5h
C175r/min,4hD225r/min,4h
【答案】Br-/I-(写出1个即可得分);
NaCl/氯化钠;
(或能写出阅读资料中提及的物质也可得分)CaCl2+Na2CO3=CaCO3↓+2NaCl探究其它条件相同时,碳酸钠加入量对钙除去率的影响反应时间AC
⑴海水中90%左右是氯化钠,另外还含有MgCl2、MgSO4、CaCl2、KI及NaBr等,海水中含有的阴离子包括Cl-、SO42-及Br-(或I-);
⑵苦卤是氯化钠析出后留下来中的,所以是氯化钠的饱和溶液,因此溶质主要有:
氯化镁、金属溴化物和NaCl;
⑶①该对比实验中发生反应的化学方程式是:
CaCl2+Na2CO3=CaCO3↓+2NaCl;
②实验a和b,搅拌速度和反应时间都相同,加入碳酸钠的质量不同,故进行实验a和b的目的是探究其它条件相同时,碳酸钠加入量对钙除去率的影响;
③对比b和d,实验显示反应时间对钙的除去率的影响很小;
在A200r/min,3.5h、B200r/min,4.5h中选择A;
在C175r/min,4h、D225r/min,4h中选择C。
故本小题应选择的反应条件是AC。
【点睛】
本题属于综合题,首先要读懂题中所给资料,然后根据问题回答。
4.科普阅读理解
阅读下面的科普短文。
第24届联合国气候大会召开,讨论的核心物质就是CO2.CO2的浓度在过去很长的时间里都保持在一定的范围,随着工业的发展以及化石燃料的大量使用,CO2的排放量不断增加。
全球碳循环如图所示:
如何降低大气中CO2浓度,是人类一直在研究的重要议题。
海洋封存:
利用庞大的水体使海洋成为封存CO2的容器,但会引起海水酸化等。
地质封存:
将CO2注入特定的地层,该方法最大的风险是CO2泄漏,局部CO2浓度快速上升,直接威胁人类生命健康等。
矿石碳化:
利用矿石中的氧化镁或氧化钙等,在一定条件下与CO2反应,生成碳酸镁或碳酸钙等,但过程缓慢。
综合利用:
工业上可以将CO2转化成尿素[CO(NH2)2]、甲醇(CH3OH)等资源。
2017年8月,科学家发现了一种镍与有机物组成的混合催化剂,利用太阳光能,将水中溶解的CO2转化成CO和O2。
在二氧化碳的处理过程中,化学起着不可替代的作用。
依据文章内容,回答下列问题。
(1)在全球碳循环中,能消耗二氧化碳的途径是____。
(2)化石燃料燃烧会产生二氧化碳,因为化石燃料中含有____元素。
(3)上述综合利用CO2得到的产品中,属于氧化物的是____。
(4)写出上述将CO2转化成CO和O2的化学方程式____。
(5)下列说法错误的是____。
A碳循环中的“碳”是指碳单质
BCO2是温室气体,对人类生活有害无利
C海洋封存CO2会引起海水酸化,发生了反应CO2+H2O═H2CO3
D矿石碳化过程中,可能发生反应MgO+CO2
MgCO3
【答案】光合作用碳CO
AB
(1)在全球碳循环中,能消耗二氧化碳的途径是光合作用;
(2)化石燃料中均含有碳元素,所以化石燃料燃烧会产生二氧化碳;
(3)氧化物是由两种元素组成的化合物,其中含有氧元素,所以上述综合利用CO2得到的产品中,属于氧化物的是一氧化碳;
(4)一种镍与有机物组成的混合催化剂,利用太阳光能,将水中溶解的CO2转化成CO和O2,化学方程式为:
;
(5)A、碳循环中的“碳”是指碳元素,故错误;
B、CO2是温室气体,对人类生活有害,也有利,可以缓解冰川时代的到来,故错误;
C、海洋封存CO2会引起海水酸化,发生了反应CO2+H2O═H2CO3,故正确;
D、矿石碳化过程中,可能发生反应MgO+CO2
MgCO3,故正确。
5.阅读下面科普短文(原文作者:
袁越)。
二氧化碳是著名的温室气体,它能让太阳光顺利通过,却会阻止地表热量的散失。
在地球形成的初期,太阳的辐射强度只有现在的四分之一,为什么那时的地球没有被冻成冰球呢?
最新的理论认为,液态的水(比如降雨)能够溶解空气中的二氧化碳,再把它变为碳酸盐,沉积到岩石层中。
同时,地球的内部很热,沉积在地壳中的碳经常会随着火山喷发而重新变为二氧化碳释放到大气中,这就形成了一个碳循环。
经过几亿年的时间,这个碳循环逐渐达到了某种平衡,使大气中的二氧化碳保持一定的含量。
正是由于这些二氧化碳产生的温室效应,使得地球的温度不至于太冷。
生命的诞生促成了另一个碳循环。
众所周知,生命的基础是光合作用,就是利用太阳提供的能量,把二氧化碳中的碳元素提取出来,连接成一条长短不一的碳链。
这样的碳链被称为“有机碳”,因为它既能作为生命的“建筑材料”,搭建成生命所需的各种有机分子(碳水化合物、蛋白质和氨基酸等),又能“燃烧自己”,产生能量供生命使用。
有机碳的燃烧过程又可以称之为“氧化反应”,其产物就是二氧化碳和水。
南极冰钻的结果证明,地球大气中的二氧化碳浓度在过去的1万年里基本保持稳定。
但自工业化以来,由于化石燃料的大量使用,二氧化碳浓度开始逐年上升,同时段内地球大气层的平均温度也发生了变化。
(见表一和表二)
目前燃烧化石能源而产生的二氧化碳,大气中的实际含量比理论计算值少一倍。
有证据显示,大气中二氧化碳浓度的提高加快了森林的生长速度,促进了土壤对二氧化碳的吸收,这说明大自然正在努力地试图平衡人类带来的影响。
但是,大自然的平衡能力是有限的,面对突然多出来的这些“碳”,大自然一时也应付不过来了,所以人类必须自己想办法。
下图是当前人类为降低大气中的二氧化碳浓度所采取的措施。
(有删改)
(1)在地球形成的初期,地球没有被冻成冰球的原因是。
(2)人类使用化石燃料使大气中二氧化碳浓度逐年上升。
下列物质中,属于化石燃料的是(填字母序号,下同)。
A.天然气B.煤C.酒精D.石油
(3)观察表一和表二后,小德认为二氧化碳排放量的持续增加导致地球大气层平均温度持续升高,但小威却不同意他的观点。
下列不同年份间数据变化的总趋势能支持小威说法的是。
A.1900~1910B.1910~1940C.1940~1980D.1980以后
(4)人类为降低大气中二氧化碳浓度采取的措施有:
开发新能源、植树造林、(写出一条即可)等。
(5)关于碳循环,下列说法正确的是。
A.二氧化碳是温室气体,对人类的生活有害无利
B.保持自然界的碳循环处于平衡状态是至关重要的
C.人类过多的工业活动产生大量的二氧化碳,打破了碳循环的平衡
D.当碳循环的平衡状态被破坏时,大自然完全具有自我修复的能力
【答案】碳循环逐渐达到了某种平衡,使大气中的二氧化碳保持一定的含量。
正是由于这些二氧化碳产生的温室效应,使得地球的温度不至于太冷ABDA采用物理或化学方法,人工吸收二氧化碳(合理即可)BC
(1)由题可知,碳循环逐渐达到了某种平衡,使大气中的二氧化碳保持一定的含量。
正是由于这些二氧化碳产生的温室效应,使得地球的温度不至于太冷,故地球没有被冻成冰球;
(2)煤、石油、天然气是化石燃料,酒精不是化石燃料,故选ABD;
(3)由图可知,在1900~1910年段,图一中生成二氧化碳的量在增加,但是在图二中该年段的温度却在降低,故选A;
(4)降低大气中二氧化碳浓度采取的措施很多,比如绿色出行,人工吸收二氧化碳等等;
(5)A、二氧化碳气体有有利的地方,比如光合作用、气体肥料等,但也会形成温室效应,故错误;
B、自然界的碳循环不平衡的话会造成许多负面的影响,故正确;
C、人类大面积的推行工业,难免会释放出较多的二氧化碳,打破了碳循环的平衡,正确;
D、大自然的自我修复的能力有一点的限度,过多产生二氧化碳,超出了大自然的自我修复能力范围,就会出现温室效应,错误。
故选BC。
6.阅读材料,回答问题:
2008年9月,中国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因是奶粉中含有三聚氰胺。
三聚氰胺性状为纯白色单斜棱晶体,化学式C3N6H6[C3N3(NH2)3],无味,密度1.573g/cm3(16℃)。
常压熔点354℃(分解);
快速加热升华,升华温度300℃。
溶于热水,微溶于冷水。
低毒。
在一般情况下较稳定,但在高温下可能会分解放出氰化物,氰化物通常具有毒性。
(1)请总结三聚氰胺的物理性质(写一点):
________________________________;
(2)三聚氰胺属于__________(填“混合物”或“纯净物”);
(3)为安全起见,一般采用三聚氰胺制造的食品都会标明“不可放进微波炉使用”。
试解释相关原因:
___________________________________。
【答案】纯白色单斜棱晶体,无味等纯净物高温下可能会分解放出有毒的氰化物
物理性质是不通过化学变化就表现出的性质。
(1)三聚氰胺的物理性质:
纯白色单斜棱晶体,无味等
(2)三聚氰胺是化合物,故属于纯净物。
(3)在一般情况下较稳定,但在高温下可能会分解放出氰化物,氰化物通常具有毒性,为安全起见,一般采用三聚氰胺制造的食品都会标明“不可放进微波炉使用”,原因:
高温下可能会分解放出有毒的氰化物。
7.阅读下面科普短文。
土豆是继水稻、小麦、玉米之后的第四大粮食作物,含淀粉、蛋白质、维生素C等多种营养物质,是餐桌上的美味食材。
表1鲜土豆中主要营养物质的含量(每100g)
蛋白质/g
脂肪/g
淀粉/g
钙/mg
磷/mg
维生素C/mg
1.5-2.3
0.4-0.94
17.5-28.0
11-60
15-68
20-40
土豆切开后发生褐变,用水浸泡能防止褐变,但会引起营养物质流失。
用土豆片进行实验,测得其食用品质、淀粉含量和维生素C含量随浸泡时间的变化如下:
土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒,就算是把变绿、发芽的部位削掉,也不宜食用。
除食用外,土豆还可以作为原料广泛用于医药、化工、纺织、造纸等工业中。
(1)表1中的“钙”指的是______________(填“元素”或“原子”)。
(2)由图1可知:
60min内,_________(填序号,下同)。
A浸泡30min比10min脆性分值高
B浸泡10min,硬度、咬碎感均无明显变化
C随着浸泡时间的增加,粘结性、弹性分值均降低
(3)由图2可知:
土豆片的淀粉含量与浸泡时间的关系是_______________________。
(4)変绿、发芽的土豆不宜食用,其原因是___________________________________。
(5)下列说法正确的是_____________。
A土豆是四大粮食作物之一B土豆中维生素C含量最高
C用水泡可防止土豆片褐変D土豆开发应用的前景广阔
【答案】元素ABC在其他条件相同时,在研究范围内,土豆片的淀粉含量随浸泡时间的延长而降低土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒ACD
(1)一般情况下,没有特别说明,表1中“钙”、“磷”是指元素,故此空填写:
元素;
(2)A、由图1可知:
60min内,浸泡30min比10min脆性分值高,故符合题意;
B、浸泡10min,硬度、咬碎感跟0min比,均无明显变化,故符合题意;
C、由图1可知:
60min内,随着浸泡时间的增加,粘结性、弹性分值均降低,故符合题意。
(3)由图2可知,随横坐标数值的增加,曲线的纵坐标在逐渐减少,故填写:
在其他条件相同时,在研究范围内,土豆片的淀粉含量随浸泡时间的延长而降低;
(4)由题干文字可知,変绿、发芽的土豆不宜食用,其原因是土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒;
(5)A、由题干文字可知,土豆是四大粮食作物之一,故符合题意;
B、由表1可知,土豆中维生素C含量不是最高,“磷”和“钙”的含量有可能比它高,故不符合题意;
C、由题干文字可知,用水泡可防止土豆片褐変,故符合题意;
D、由题干文字可知,土豆开发应用的前景广阔,故符合题意。
8.化学与药品研发
2015年,屠呦呦因发现青蒿素并成功研制出抗疟新药,成为我国本土第一位诺贝尔生理学或医学奖得主。
我国的许多医学著作中都有使用青蒿治疗疟疾的记载。
屠呦呦团队通过研究,发现了青蒿素,确定了它的组成、结构,并成功合成。
(1)提取过程
研究人员先是采用水煎法(将青蒿放入水中,加热煮沸、浓缩),发现得到的提取物对疟原虫无抑制效果;
而采用95%的乙醇(乙醇沸点78℃)为溶剂进行提取,得到的提取物有效率为30%~40%;
后来又采用乙醚(沸点35℃)为溶剂,得到的提取物有效率达到95%以上。
课题组将提取物中的有效成分命名为青蒿素。
根据青蒿素的提取过程推测青蒿素的物理性质和化学性质(各写一条)____________和__________________________等。
(2)结构分析
确定中草药成分的化学结构是药物研制过程中十分重要的一环。
在成功分离出青蒿素晶体后,课题组立即着手分析其化学结构。
①定性分析
取适量青蒿素,在氧气中充分燃烧,测得生成物只有二氧化碳和水,由此推断青蒿素中一定合有的元素是(用符号表示)___________________。
②定量分析
实验测得青蒿素的相对分子质量是282,其中碳元素的质量分数是63.8%,氢元素的质量分数是7.8%,根据以上信息,写出确定一个青蒿素分子中氧原子个数的计算式(只列式,不计算结果)__。
③主要抗疟结构分析
青蒿素对疟原虫有很好的抑制作用,可能是因为它有较强的氧化性,青蒿素分子中具有怎样的结构才使它有较强的氧化性呢?
我们熟悉的过氧化氢溶液有较强的氧化性,医疗上常用它杀菌消毒,过氧化氢分子中原子间相互结合的方式有“H-0-、-0-0-”两种,青蒿素分子中原子间相互结合的方式有“
”等几种。
你认为青蒿素分子中起杀菌作用的原子间相互结合的方式是_________________。
以上是运用已有知识进行的推理,推理是否正确,需要通过________________进行验证。
(3)化学合成
青蒿中青蒿素的含量只有0.1%~1%,课题组于1984年成功合成了青蒿素。
请你谈一谈化学合成青蒿素有哪些优点(答一点即可)_________________________。
【答案】不溶于水(或能溶于乙醇或易溶于乙醚或能溶于有机溶剂)受热不稳定(或受热易变质或受热易分解或热稳定性差或能杀菌或能抑制疟原虫)C、H
-O-O-实验产量高(或可以规模生产或减少占地耕地或不受季节限制)
(1)根据青蒿的提取过程分析,青蒿素的物理性质:
不溶于水(或能溶于乙醇或易溶于乙醚或能溶于有机溶剂),青蒿素的化学性质:
受热不稳定(或受热易变质或受热易分解或热稳定性差或能杀菌或能抑制疟原虫)
(2)①根据质量守恒定律:
化学反应前后,元素的种类不变,故结合青蒿素在氧气中充分燃烧,测得生成物只有二氧化碳和水,由此推断青蒿素中一定合有的元素是C、H
②根据相对分子质量的计算方法,一个青蒿素分子中氧原子个数的计算式
③根据过氧化氢溶液有较强的氧化性,医疗上常用它杀菌消毒,而具有氧化性的原子是氧原子,故可青蒿素分子中起杀菌作用的原子间相互结合的方式是-O-O-;
以上是运用已有知识进行的推理,推理是否正确,需要通过实验进行验证
(3)根据信息:
青蒿中青蒿素的含量只有0.1%~1%,课题组于1984年成功合成了青蒿素,故化学合成青蒿素的优点:
产量高(或可以规模生产或减少占地耕地或不受季节限制)
9.阅读科普短文
稀土材料
稀土元素是指元素周
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 备战 中考 化学 试题 分类 汇编 科普 阅读 综合 答案 解析
 冰点文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰点文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 建筑工程编制依据及概况.docx
建筑工程编制依据及概况.docx
